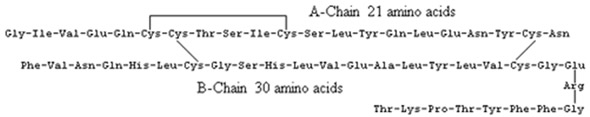A insulina tem função de
não deixar que a concentração de glicose no plasma sanguíneo tenha grandes
variações, apesar da grande variação na quantidade de glicose ingerida. Este
hormônio é produzido pelas células β das ilhotas pancreáticas, o seu precursor,
a pró-insulina é clivada em insulina e peptídeo C, que são armazenados nas
células β e secretados conjuntamente quando há estimulo.
O peptídeo C é
utilizado no acompanhamento da quantidade de insulina que ainda é secretada, mesmo
nos pacientes em insulinoterapia, servindo como referencia para produção
endógena desse hormônio. É uma forma mais barata de medir indiretamente a quantidade de insulina.
Após uma refeição a
glicemia de um indivíduo saudável aumenta rapidamente, tem pico entre 30 e 60
minutos e retorna aos níveis basais em 2 a 3 horas. A concentração plasmática
de insulina tem um padrão similar ao da glicose, inicialmente há um rápido
aumento da secreção durando cerca de 10 minutos (primeira fase), essa fase é
seguida por uma secreção maior que a taxa basal (segunda fase) e dura algumas horas
até ao nível basal de secreção.
Após o final da
absorção de glicose da refeição a produção hepática de glicose aumenta,
enquanto a secreção de insulina diminui, mas não cessa, mantendo sua secreção
basal. A glicose é utilizada como substrato energético em todos os tecidos do
corpo e necessita da insulina para entrar nesses tecidos, com exceção dos
neurônios e células do miocárdio. Em estado de privação alimentar a ausência de
insulina estimula a lípase hormônio sensível e a liberação de ácidos graxos livres
de tecidos adiposos, o que estimula a produção hepática e a liberação de corpos
cetônicos, o que leva a Cetose. Os portadores de DM tipo 1 não contem essa
secreção basal de insulina, por isso a não administração de insulina leva ao
estado conhecido como cetoacidose diabética, que é muitas vezes
o quadro que diagnostica a doença. Por isso a importância da administração da insulina.
Em portadores de
diabetes cuja produção de insulina pelo próprio organismo está diminuída ou
ausente é necessária sua reposição para normalizar a capitação de glicose pelas
células. Há diversos tipos de insulina que se diferem quanto ao inicio, pico e
duração da ação, características que determinam as aplicações de insulina como
basais (NPH e análogos de insulina basal) e bolus
(rápida e ultrarrápida). Para escolha adequada da insulina ou combinação de
diferentes tipos devem ser consideradas as características individuais do
paciente e seus hábitos de vida.
A insulina humana tem a formula seguinte:
A insulina NPH (Neutral
Protamine Hagedorn) é a insulina regular combinada com protamina, o que diminui
sua solubilidade e lentifica a sua absorção.
A insulina Glargina é
feita a partir de duas modificações na molécula de insulina humana: adição de
arginina ao carbono final da cadeia β, o que deixa a molécula menos solúvel ao
pH do tecido subcutâneo e substituição da aspartina na posição 21 por glicina,
estabilizando a molécula.
A insulina Detemir tem
ácidos graxos ligados à lisina da posição 29, o que aumenta a sua ligação com
albumina e lentifica a sua absorção.
A Lispo difere da
insulina humana por ter a lisina na posição 29 trocada com a prolina na posição
28, deixando-a mais solúvel e, então, é absorvida mais rapidamente. O mesmo
ocorre com a Aspart, que tem a prolina da posição 28 substituída por uma
molécula de acido aspártico.
Insulina
|
Inicio
de ação
|
Pico
de ação
|
Duração
de ação
|
Aspart/Lispro
|
< 15 minutos
|
1 a 2 horas
|
3 a 5 horas
|
Regular
|
30
a 60 minutos
|
2
a 4 horas
|
6
a 8 horas
|
NPH
|
1 a 3 horas
|
5 a 8 horas
|
13 a 16 horas
|
Glargina/Detemir
|
±
2 horas
|
“planas”
|
±
24 horas
|
No DM tipo 1 a destruição autoimune das células β, em alguns meses leva à insuficiência na secreção de insulina, essa insuficiência é caracterizada clinicamente quando há destruição de pelo menos 80% das células β pancreáticas, nesse momento geralmente é feito o diagnostico. Diversos fatores genéticos e ambientais estão envolvidos nesse processo autoimune, por isso a etiologia do DM tipo 1 é multifatorial, por exemplo a presença de determinada genotipagem de antígenos leucocitários humanos associada a pelo menos dois anticorpos específicos já pode ser vista como período pré-clinico da doença. O quadro clinico ao diagnostico pode evoluir de polidipsia, poliúria, perda de peso e astenia até cetoacidose diabética e coma hiperosmolar.
Há dois esquemas básicos
de insulinoterapia para pacientes com DM tipo 1: o convencional e o intensivo.
O convencional
baseia-se em uma ou duas injeções diárias de insulina NPH isoladamente ou
combinada com insulina de ação rápida ou ultrarrápida. As vantagens desse
esquema são o numero menor de injeções e possibilidade das injeções serem
preparadas antecipadamente, pois a dose não depende da glicose. No entanto não
diminui a incidência e a progressão das complicações micro e macrovasculares do
diabetes, com evidencia dos estudos DCCT e EDIC.
Após esses estudos, a
insulinoterapia mais indicada no tratamento do DM tipo 1 é a intensiva, por
diminuir as suas complicações.
O esquema intensivo,
também é chamado de esquema com múltiplas doses de insulina (MDI), procura mimetizar
a secreção fisiológica de insulina, com uma insulina de ação intermediaria ou
prolongada e uma insulina de ação rápida ou ultrarrápida, ou somente de ação
ultrarrápida em bomba de infusão de insulina. O esquema intensivo demanda mais
dedicação do paciente ao tratamento, pois ele requer automonitorização e, em
alguns casos contabilizar a ingestão de carboidratos.
No diabetes tipo 2, o processo
de exaustão das células β ocorre lentamente, por isso a introdução da insulina
costuma não ocorrer logo ao diagnostico, embora haja situações em que o inicio
precoce dessa forma terapêutica seja necessário. Acredita-se que a
insulinoterapia no DM tipo 2 diminuiria a lipo e a glicotoxidade e a
resistência à insulina, permitindo que, após a compensação aguda do quadro,
dieta e apenas um tipo de antidiabético oral seriam suficientes para manter um
bom controle glicêmico a longo prazo.
O tratamento geralmente
é iniciado com antidiabéticos orais, que podem estimular a secreção pancreática
de insulina ou diminuir a resistência periférica ou hepática à insulina. A
introdução de insulina no tratamento está indicada quando há intercorrências,
como infecções, estado hiperglicêmico hiperosmolar, gestação, infarto agudo do
miocárdio, pré ou pós-operatório de cirurgias eletivas ou de urgência, ou então
nos casos em que não se consegue bom controle glicêmico com antidiabéticos
orais em doses máximas, sinalizando uma perda importante da função pancreática.
A insulinoterapia
geralmente é iniciada em dose única de insulina basal antes de dormir de forma
que a ação da insulina tenha pico ao amanhecer, momento em que há aumento na
secreção de hormônios contrarreguladores da insulina e elevação da glicemia. Em
obesos as doses devem ser ajustadas de acordo com os valores de glicemia
capilar em jejum a cada 3 dias, até obter a dose que atinge aos alvos
glicêmicos, ou seja, evita hiper e hipoglicemias.
Bibliografia: Manual de Diabetes Mellitus: Liga do Controle de Diabetes Mellitus do Hospital das Clínicas da Faculdade de Medicina- USP
POSTADO POR LOURRANE CAROLINE